

|
Статьи \ Клинические исследования \ Экспериментальные исследования адсорбционных свойств БАД к пище «Литовит»
03.02.2013
Экспериментальные исследования адсорбционных свойств БАД к пище «Литовит»
В процессе жизни человек испытывает и переносит эндогенную интоксикацию не раз – при гриппе или банальных простудах, расстройствах пищеварения или высокой температуре, неблагоприятной экологической обстановке и во многих других случаях. Если перейти от субъективных восприятий эндогенной интоксикации (ощущение болезни и плохого состояния), то эндогенная интоксикация рассматривается как синдром, характерный для многих патологических процессов и состояний, в основе которого лежат разнообразные повреждающие воздействия. Одним из путей решения проблем интоксикаций, связанных с загрязнением окружающей среды и поступлением в организм человека загрязняющих веществ, является системное потребление энтеросорбентов природного происхождения, которые связывают и выводят токсины из организма. Применение сорбентов на основе природного цеолита – БАД серии «Литовит» - это простой, доступный и одновременно эффективный метод, который применим как дополнение к комплексной терапии, так и для профилактики экологически обусловленных заболеваний. История появления сорбента на основе цеолита Холинского месторождения описана нами в издании «Цеолиты. Эволюция знаний. Том 1» на страницах 29-42 Данная глава настоящего издания содержит материалы экспериментальных исследований БАД к пище «Литовит-М» в лабораторных условиях, материалы предварительных испытаний на животных, а также клинические испытания, позволяющие дать оценку представленному продукту как энтеросорбенту. Материалы отчета «Об экспериментальном исследовании «Литовит-М» в качестве энтеросорбента». Данные исследования проводились в Российской Академии медицинских наук,НИИ фармакологии Томского Научного Центра СО РАМН в 2001 году. Для исследования сорбционной активности in vitro и in vivo использовали БАД к пище «Литовит-М» - 100% очищенный и активированный природный цеолит. Препаратом сравнения служили измельченные до порошкообразного состояния «Таблетки активированного угля». Статистическую обработку результатов проводили по t-критерию Стьюдента с использованием стандартного пакета программ Windows 95. ИССЛЕДОВАНИЕ АДСОРБИРУЮЩЕЙ АКТИВНОСТИ «ЛИТОВИТ-М» В ОПЫТАХ IN VITRO Изучение алкалоидадсорбирующей активности «Литовит-М». Адсорбционная активность «Литовит-М» по сравнению с активированным углем исследована в отношении алкалоида – атропина8. Навески «Литовит-М» и активированного угля по 0,02 г помещали в центрифужные пробирки, прибавляли 5 мл атропина в концентрации 50 мг/л и встряхивали 20 минут. Затем центрифугировали 25 мин при 3000 об/мин на центрифуге РС-6. Отбирали по 4 мл супернатанта и измеряли оптическую плотность проб при длине волны 190 нм (максимум пика оптической плотности для атропина) против дистиллированной воды на спектрофотометре Hitachi – 557. По предварительно построенной калибровочной кривой определяли концентрацию алкалоида в растворах после контакта с адсорбентами и рассчитывали адсорбционную активность адсорбентов. Таблица 38. Адсорбирующая активность активированного угля и «Литовита-М» по отношению к атропину в опытах in vitro.
Изучение барбитуратадсорбирующей активности «Литовит-М» Адсорбционная активность «Литовит-М» по сравнению с активированным углем исследована в отношении этаминал – натрия9. Навески исследуемых веществ по 0,08 г помещали в центрифужные пробирки, прибавляли 5 мл раствора этаминал – натрия в концентрации 0,2 г/л и встряхивали 20 минут. Затем центрифугировали 30 минут при скорости 3000 об/мин на центрифуге РС – 6. Отбирали супернатант и проводили количественное определение содержания этаминал – натрия в соответствии с требованиями фармакопейной статьи на препарат «Таблетки этаминал – натрия 0,1 г» (Государственная фармакопея РФ выпуск X, статья 68). Для этого в 5 мл супернатанта добавляли 5 капель индикатора метилового оранжевого и титровали 0,01 н раствором соляной кислоты до появления розового окрашивания. По предварительно построенной калибровочной кривой определяли концентрацию этаминал – натрия в растворах после контакта с адсорбентами и рассчитывали адсорбционную активность адсорбентов. Таблица 39. Адсорбирующая активность активированного угля и «Литовит-М» по отношению к этаминал – натрию в опытах in vitro.
Как видно из таблицы 39, по адсорбирующей активности в отношении этаминал – натрия «Литовит-М» не уступает активированному углю. Изучение адсорбирующей активности «Литовита-М» по отношению к трициклическим антидепрессантам. Исследована адсорбционная активность «Литовит-М» по сравнению с активированным углем в отношении к амитриптилину10. Навеску исследуемых веществ («Литовит-М» и активированного угля) по 0,02 г помещали в центрифужные пробирки, прибавляли 5 мл раствора амитриптилина (концентрацией 50 мг/л) и встряхивали 20 минут. Затем центрифугировали 30 минут при 3000 об/мин на центрифуге РС – 6. Отбирали 4 мл супернатанта и измеряли оптическую плотность проб против дистиллированной воды на спектрофотометре Hitachi – 557 при длине волны 235 нм. По предварительно построенной калибровочной кривой определяли концентрацию амитриптилина в растворах после контакта с адсорбентами и рассчитывали адсорбционную активность. Таблица 40. Адсорбирующая активность активированного угля и «Литовит-М» по отношению к амитриптилину в опытах in vitro.
Как видно из таблицы 40, по адсорбирующей активности в отношении амитриптилина «Литовит-М» не уступает активированному углю. Изучение адсорбирующей активности «Литовит-М» по отношению к мышьяку При определении адсорбирующей активности в отношении соединения мышьяка – арсената натрия (Na2 AsO3) навески «Литовит-М» и активированного угля по 0,32 г помещали в центрифужные пробирки, прибавляли 6 мл раствора арсената натрия концентрации 670 мг/л и встряхивали 20 минут. Затем центрифугировали 30 минут при 3000 об/мин на центрифуге РС – 6. Отбирали супернатант и проводили количественное определение содержания арсената натрия в соответствии с требованиями Государственной фармакопеи РФ (ГФ X, ст. 439). Для этого к 1,5 мл супернатанта добавляли 0,5 мл концентрированной соляной кислоты, раствор нагревали до 400С и вносили 0,6 г йодистого калия; колбу закрывали притертой крышкой и ставили в темное место на 30 минут. Полученный раствор разводили 10 мл воды. В качестве индикатора использовали 50 мкл 1% крахмальной слизи. Титрование проводили 0,01 н раствором тиосульфата натрия до исчезновения окрашивания. По предварительно построенной калибровочной кривой определяли концентрацию арсената натрия в растворах до и после контакта с адсорбентами и рассчитывали адсорбционную активность адсорбентов. Таблица 41. Адсорбирующая активность активированного угля и «Литовит-М» по отношению к арсенату натрия в опытах in vitro.
Как видно из таблицы 41, по адсорбирующей активности в отношении арсената натрия «Литовит-М» не уступает активированному углю. Изучение адсорбирующей активности «Литовит-М» по отношению к меди. При определении адсорбционной активности в отношении медного купороса (CuSO 4 *5H 2 O) навески «Литовит-М» и активированного угля по 0,36 г помещали в центрифужные пробирки, прибавляли 6 мл медного купороса концентрации 1 г/л и встряхивали 20 минут. Затем центрифугировали 30 минут при скорости 3000 об/мин на центрифуге РС – 6. Отбирали супернатант и проводили количественное определение содержания медного купороса в соответствии с требованиями Государственной фармакопеи РФ (ГФ X, ст. 218). Для этого к 5 мл супернатанта добавляли 0,3г йодистого калия. В качестве индикатора использовали 50 мкл 1% тиосульфата натрия до исчезновения окрашивания. По предварительно построенной калибровочной кривой определяли концентрацию медного купороса в растворах до и после контакта с адсорбентами и рассчитывали адсорбционную активность. Таблица 42. Адсорбирующая активность активированного угля и «Литовит-М» по отношению к медному купоросу в опытах in vitro.
Как видно из таблицы 42, по адсорбирующей активности в отношении медного купороса «Литовит-М» не уступает активированному углю. Изучение адсорбирующей активности «Литовит-М» по отношению к барию При определении адсорбционной активности в отношении хлорида бария (BaCl 2 *2H 2 O) навески «Литовит-М» и активированного угля по 1 г помещали в центрифужные пробирки, прибавляли 25 мл раствора хлорида бария в концентрации 3,0 г/л и встряхивали 20 минут, после чего растворы фильтровали. Далее проводили количественное определение содержания хлорида бария в соответствии с требованиями Государственной фармакопеи (ГФ X, ст. 873). Для этого к 20 мл фильтрата добавляли 1 мл горячей разведенной соляной кислоты. К полученному раствору добавляли 25 мл горячего раствора сульфата натрия. Для дальнейшего протекания реакции пробирки помещали на 30 минут на водяную баню, нагретую до 800С. Затем пробы профильтровывали через обеззоленные фильтры «синяя лента». Избыток хлора отмывали горячей дистиллированной водой. Фильтры с полученным осадком переносили во взвешенные тигли, высушивали в термостате, сжигали и прокаливали. После чего определяли массу бария сульфата и по предварительно построенной калибровочной кривой находили соответствующую концентрацию бария хлорида в растворах после контакта с адсорбентами и рассчитывали адсорбционную активность. Таблица 43. Адсорбирующая активность активированного угля и «Литовит-М» по отношению к хлориду бария в опытах in vitro.
Как видно из таблицы 43, по адсорбирующей активности в отношении хлорида бария «Литовит-М» существенно превосходит активированный уголь. Изучение адсорбирующей активности «Литовита-М» по отношению к свинцу. При определении адсорбционной активности в отношении ацетата свинца ((CH 3 COO) 2 Pb*3H 2 О) навески «Литовита-М» и активированного угля по 0,024 г помещали в центрифужные пробирки, прибавляли 6 мл ацетата свинца в концентрации 1 г/л и встряхивали 20 минут, после чего центрифугировали 30 минут при 3000 об/мин на центрифуге РС – 6. Отбирали супернатант и проводили количественное определение содержания ацетата свинца. Концентрацию ацетата свинца оценивали по реакции образования трудно растворимой в воде соли сульфата свинца (М. К. Стругацкий, Б. П. Надеинский. Общая химия. 1965, с.259-262). Для этого к 5 мл супернатанта добавляли 5 мл раствора сульфата натрия в концентрации 1 г/л. Для дальнейшего протекания реакции пробирки помещали на 50 минут на водяную баню, нагретую до 800С. Затем пробы профильтровывали через обеззоленные фильтры «синяя лента». Пробы трехкратно отмывали эквиообъемным количеством горячей дистиллированной водой. Фильтры с полученным осадком переносили во взвешенные тигли, высушивали в термостате, сжигали и прокаливали. После этого определяли массу сульфата свинца и по предварительно построенной калибровочной кривой находили соответствующую концентрацию ацетата свинца в растворах после контакта с адсорбентами и рассчитывали адсорбционную активность. Таблица 44. Адсорбирующая активность активированного угля и «Литовит-М» по отношению к ацетату свинца в опытах in vitro.
Как видно из таблицы 44, по адсорбирующей активности в отношении ацетата свинца «Литовит-М» превосходит активированный уголь. Примечание к исследованиям адсорбирующей активности «Литовита-М» в опытах in vitro: Расчет адсорбционной активности во всех случаях проводили по формуле: Х = ((С1 – С2) * V)/ м Где: С 1 – концентрация исходного вещества в мг/л; ИССЛЕДОВАНИЕ АДСОРБИРУЮЩЕЙ АКТИВНОСТИ «ЛИТОВИТ-М» В ОПЫТАХ IN VIVO Изучение защитного действия «Литовит-М» при отравлении атропином показало, что применение «Литовит-М» при интоксикации атропином препятствует развитию выраженных нарушений кислотно – щелочного равновесия, существенно уменьшает нарушения электрической активности сердца, увеличивает продолжительность жизни в случае летального отравления. По показателю снижения смертности «Литовит-М» не уступает активированному углю, а по способности ограничивать патологические сдвиги отдельных показателей ЭКГ превосходит активированный уголь. Эксперименты проведены на 18 беспородных крысах – самцах массой 310 – 330 г. ЭКГ у животных регистрировали на электроэнцефалографе EEG-8S во II отведении. На кривых ЭКГ определяли длительность интервалов PQ, QRS и QT, амплитуду зубцов Р, R и Т. С помощью анализатора ABL-4 оценивали показатели кислотно – щелочного состояния венозной крови. Забор крови производили из кончика хвоста. В пробах крови определяли рН, рО 2 (мм.рт.ст.), рСО 2 (мм.рт.ст.), актуальный бикарбонат (НСО 3, мМ/л), общий СО 2 (ТСО 2, мМ/л), актуальный избыток оснований (АВЕ, мМ/л) и стандартный бикарбонат крови (SBC, мМ/л). После регистрации исходных значений исследуемых показателей вводили атропин в дозе 900 мг/кг внутрижелудочно в 1% крахмальной слизи в объеме 6 мл/кг. Через 10 минут после отравления животным внутрижелудочно вводили 5 мл/кг 1% крахмальной слизи (контрольная группа, n = 6), либо взвеси «Литовит-М» (120 мг/кг) в 1% крахмальной слизи (n = 6), либо взвеси активированного угля (250 мг/кг) в 1% крахмальной слизи (n = 6). Регистрацию исследуемых показателей производили через 1, 2 и 4 часа после отравления атропином. В течение первых часов отмечали время жизни отравленных животных, через 1 сутки определяли выживаемость животных. Статистическую обработку результатов проводили по t-критерию Стьюдента с использованием пакета статистических программ «Statisica for Windows 4.0». Интоксикация атропином в контрольной группе приводила к появлению выраженной одышки, гипертермии и гиперемии кожи. Гипервентиляция и увеличение притока крови к коже вызывали артериализацию венозной крови – происходило достоверное повышение рН, рО 2 и снижение рСО 2 венозной крови в течение всего периода наблюдения. К 1-2 часам отмечалось снижение актуального бикарбоната, общего СО 2, к 2-4 часам выявлен рост стандартного бикарбоната в венозной крови (см. таблицу 45). Несмотря на исходно высокий симпатический тонус у крыс, развивалась выраженная тахикардия; в связи с повышением частоты сердечных сокращений (ЧСС) уменьшилась продолжительность интервала QT. Отражением гипоксии и метаболических нарушений в миокарде явилось уширение QRS на фоне повышения ЧСС к 1 часу и снижение амплитуды зубца R к 1 и 2 часам после отравления (см. таблицу 46). К первым суткам погибло 4 животных из 6, прожив в среднем 84 минуты после введения атропина (см. таблицу 49). Применение активированного угля при отравлении атропином не приводило к существенному изменению кислотно – щелочных показателей венозной крови относительно значений у контрольной группы животных (см. таблицу 1). Сохранялись нарушения электрической активности сердца: тахикардия в течение всего периода наблюдения, депрессия зубцов R и Т к 1 часу после введения атропина. К 2 и 4 часам наблюдения отмечена лишь тенденция к снижению вольтажа зубца Т, ко 2 часу появилась тенденция к более выраженному значению амплитуды зубца Т относительно контрольной группы (см. таблицу 47). Смертность в группе животных, получавших активированный уголь, была в 2 раза ниже, чем в контроле, средняя продолжительность жизни погибших животных увеличилась в 1,4 раза (см. таблицу 49). - Использование «Литовит-М» при интоксикации атропином приводило к менее выраженным сдвигам кислотно – щелочного состояния венозной крови. Так, достоверное повышение рН отмечено лишь к 1 часу после отравления, достоверных изменений НСО 3, ТСО 2 и SBC относительно исходных значений не отмечено (см. таблицу 45). Менее выраженными были и нарушения сердечной деятельности. Так, при сохранении выраженной тахикардии и уширения интервала QRS не отмечалась депрессия зубца R (к 1 часу этот показатель достоверно превышал уровень контрольной группы, а к 1 и 4 часам – группы с введением активированного угля). Кроме того, достоверное снижение вольтажа зубца Т отмечено лишь ко 2 часу, однако и оно было достоверно менее выраженным, чем в контрольной группе (см. таблицу 48). В группе животных, получавших «Литовит-М» к 1-ым суткам погибло 2 животных из 6, продолжительность их жизни с момента отравления в 2,1 раза превысила показатель контрольной группы (см. таблицу 49). Изучение защитного действия «Литовит-М» при отравлении атропином (практические данные). Таблица 45. Показатели кислотно – щелочного состояния венозной крови при отравлении атропином у контрольных животных (n=6) и группах животных, получавших активированный уголь (n=6) и «Литовит-М» (n=6)
Таблица 46. Показатели электрической активности сердца крыс при отравлении атропином в контрольной группе животных (n=6)
Таблица 47. Показатели электрической активности сердца крыс при отравлении атропином в группе животных с введением активированного угля (n=6)
Таблица 48. Показатели электрической активности сердца крыс при отравлении атропином в группе животных с введением «Литовит-М» (n=6)
Таблица 49. Показатели смертности и средней продолжительности жизни погибших животных при отравлении атропином в контрольной группе крыс и в группах крыс, получавших активированный уголь и «Литовит-М».
Изучение защитного действия «Литовит-М» при отравлении амитриптилином. Эксперименты проведены на 19 беспородных крысах – самцах массой 310 – 330 г. У животных под легким эфирным оглушением регистрировали показатели ЭКГ в трех стандартных отведениях (длительность интервалов PQ, QRS и QT, амплитуду зубцов Р, R и Т) на электроэнцефалографе EEG – 8S. После регистрации исходных ЭКГ животным внутрижелудочно вводили амитриптилин в дозе 450 мг/кг в 1% крахмальной слизи в объеме 6 мл/кг. Через 10 минут после отравления крысам внутрижелудочно вводили 5 мл/кг 1% крахмальной слизи (контрольная группа, n=6), либо эквиобъемное количество взвеси активированного угля в 1% крахмальной слизи в дозе 250 мг/кг (n=7), либо взвеси «Литовит-М» в той же дозе и объеме (n=6). Регистрацию ЭКГ в трех стандартных отведениях проводили через 1, 2 и 4 часа после отравления амитриптилином. Поскольку одним из основных патогенетических механизмов токсического действия высоких доз амитриптилина на организм является кардиотоксический эффект, обусловленный прямым влиянием на проводящие пути и мышцу сердца, проводили учет нарушений ритма сердца и проводимости (экстрасистолии, атриовентроикулярной блокады, нарушений внутрижелудочковой проводимости, брадиаритмии). Смертность учитывали через 6 часов и 1 сутки. Статистическую обработку результатов проводили по t- критерию Стьюдента с использованием пакета статистических программ «Statisica for Windows 4.0». В контрольной группе животных введение амитриптилина приводило к появлению тахикардии (к 4 часам) и соответствующему повышению ЧСС укорочению QT (к 4 часам). Развивалась патологическая реакция удлинения интервала PQ (к 2 часам) на фоне повышения ЧСС, свидетельствующая о нарушении атриовентроикулярной проводимости. Отмечалась достоверная депрессия зубцов P I, R I, R II, TI, TII, TIII (см. таблицу 50). За 4 часа наблюдения у 50% животных развивались нарушения сердечной деятельности в виде атриовентроикулярной блокады (у 3 животных), экстрасистолии (у 1 животного), нарушения внутрижелудочковой проходимости (у 1 крысы), выраженной брадиаритмии (у 1 животного) (см. таблицу 53). Развитие аритмий и нарушений проводимости приводило к острой сердечной недостаточности и смерти животного в течение 10 – 15 минут. К 6 часу погибли все животные с выявленными нарушениями сердечной деятельности (50%). К 1 суткам погибло 4 животных из 6 (см. таблицу 54). Применение активированного угля для снижения интоксикации амитриптилином не предупреждало нарушений атриовентроикулярной проводимости (достоверное уширение PQ отмечено к 2 часам после введения амитриптилина), снижения амплитуды зубцов P II, RII, TII . Вместе с тем, менее выраженной, чем в контрольной группе, была депрессия RI к 2 часам, уменьшилось до двух количество животных с выявленными аритмиями и нарушениями проводимости и, соответственно, снизилась до 29% гибель животных в первые 6 часов (см. таблицу 54). К 1 суткам, однако, смертность животных, получавших активированный уголь, не отличалась от контрольной (погибли 2 животных из 7). Использование «Литовит-М» для устранения интоксикации амитриптилином предупреждало удлинение интервала PQ (напротив, сохранялась физиологическая реакция укорочения PQ при повышении ЧСС). Различия с контрольной группой были достоверны к 4 часам. Амплитудные изменения ЭКГ при введении «Литовит-М» были менее выраженными, чем в контрольной группе. При сохранении депрессии R I к 4 часам отмечено меньшее снижение вольтажа P I, TI b TII к 4 часам после введения амитриптилина (см. таблицу 52). Изменения сердечной деятельности в виде аритмий и нарушения проводимости отмечены за 4 часа лишь у двух животных из 6, соответственно, смертность в этот период составила 33%. К 1 суткам погибло 4 животных из 6 (см. таблицу 54). Эффективность «Литовит-М» в качестве адсорбента при отравлении амитриптилином соответствует активированному углю. Активированный уголь и «Литовит-М», использованные в ранние сроки после отравления, оказывают выраженное кардиопротективное действие, снижают смертность животных в первые часы после отравления от острой сердечной недостаточности. Изучение защитного действия «Литовит-М» при отравлении амитриптилином (практические значения). Таблица 50. Значения показателей электрической активности сердца при отравлении амитриптилином в контрольной группе крыс (n=6).
Таблица 51. Значения показателей электрической активности сердца при отравлении амитриптилином в группе крыс, получавших активированный уголь (n=7).
Таблица 52. Значения показателей электрической активности сердца при отравлении амитриптилином в группе крыс, получавших «Литовит-М» (n=6).
Таблица 53. Частота наблюдения нарушений сердечной деятельности при отравлении амитриптилином в контрольной группе животных и в группах животных, получавших активированный уголь и «Литовит-М».
Таблица 54. Показатели смертности животных (%) к 6 часам и 1 суткам при отравлении амитриптилином в контрольной группе животных и в группах животных, получавших активированный уголь и «Литовит-М».
Изучение защитного действия «Литовит-М» при отравлении дигитоксином. Эксперименты проведены на 22 беспородных мышах – самках массой 18 – 20 г. У животных под легким эфирным оглушением регистрировали показатели ЭКГ в трех стандартных отведениях (длительность интервалов PQ, QRS и QT, амплитуду зубцов P, R и Т) на электроэнцефалографе EEG-8S. После регистрации исходных ЭКГ животным внутрижелудочно вводили дигитоксин в дозе 165 мг/кг в 1% крахмальной слизи в объеме 0,3 мл на животное. Через 10 минут после отравления мышам внутрижелудочно вводили 0,3 мл на мышь 1% крахмальной слизи (контрольная группа, n = 6), либо эквиобъемное количество взвеси активированного угля в 1% крахмальной слизи в дозе 250 мг/кг (n = 8), либо взвеси «Литовит-М» в тех же дозе и объеме (n = 8). Регистрацию ЭКГ в трех стандартных отведениях проводили через 1, 3 и 5 часов после отравления дигитоксином. Учитывали нарушения ритма сердца и проводимости (экстрасистолии, атриовентрикулярную блокаду, нарушения внутрижелудочковой проводимости, брадиаритмии). Смертность определяли через 5 часов и 1 сутки. Статистическую обработку результатов проводили по t – критерию Стьюдента с использованием пакета статистических программ «Statistica or Windows 4.0». В контрольной группе животных введение дигитоксина приводило к развитию брадикардии, увеличению интервалов PQ и QRS, увеличению амплитуды R II и ТII (см. таблицу 55). У всех 6 животных в группе развивались нарушения сердечной деятельности в виде экстрасистолии (у 4), атриовентрикулярной блокады (у 2), брадикардии (у 4). К 2 часам после отравления погибло 4 животных из 6 (см. таблицу 58, 59). Введение активированного угля существенно не влияло на патологические изменения ЭКГ при отравлении дигитоксином: в течение всего периода наблюдения отмечались брадикардия, удлинение интервалов PQ и QT; через 1 час после отравления увеличился интервал QRS и вольтаж P II, а через 2 часа – амплитуда P I, R II и TII (см. таблицу 56). Нарушение ритма и проводимости развивалось у всех 8 животных, однако, они появлялись в среднем на 0,5 часа позже, чем в контрольной группе и их структура была иной: не было отмечено экстрасистолий, уменьшалось до 25% число атриовентрикулярных блокад, однако, возрастало до 75% количество нарушений внутрижелудочковой проводимости и брадикардий, что, по – видимому, было связано с увеличением средней продолжительности жизни погибших животных до 4 часов. В этой группе к 4 часам после отравления дигитоксином погибло 4 животных из 8 (см. таблицу 58, 59). Введение «Литовита-М» после отравления дигитоксином также не оказывало существенного влияния на структуру нарушений ЭКГ: в течение всего периода наблюдения отмечались брадикардия, удлинение интервалов QRS и QT, к 1 часу достоверно возрастала длительность PQ и амплитуда P I, к 3 часу – амплитуда P I, P II, R II, R III, TII, TIII. Под влиянием «Литовит-М» замедлялся рост амплитуды R II, а изменения PQ были достоверны лишь в течение 1 часа после отравления (см. таблицу 57). Нарушения ритма и проводимости наблюдались у всех 8 животных, однако, они появлялись в среднем на 2 часа позже, чем в контрольной группе. По сравнению с контрольной группой под влиянием «Литовит-М» уменьшалось количество экстрасистолий при возрастании числа атриовентрикулярных блокад, нарушений внутрижелудочковой проводимости и брадикардий. В течение 5 часов в группе, получавшей «Литовит-М» погибло 2 животных из 8, средняя продолжительность их жизни составила 4 часа (см. таблицу 58, 59). Введение адсорбентов при отравлении дигитоксином в 2 раза увеличивало среднюю продолжительность жизни погибших животных, способствовало снижению смертности в первые часы после отравления, увеличивало среднее время появления нарушений ритма и проводимости сердца (при этом более эффективным оказался «Литовит-М»), снижало количество экстрасистолий при одновременном возрастании других видов нарушений ритма и проводимости сердца, однако, не уменьшало смертность животных в 1 суткам после отравления дигитоксином в дозе 165 мг/кг. Изучение защитного действия «Литовит-М» при отравлении дигитоксином (практические данные). Таблица 55. Значения показателей электрической активности сердца при отравлении дигитоксином в контрольной группе крыс (n=6).
Таблица 56. Значения показателей электрической активности сердца при отравлении дигитоксином в группе мышей, получавших активированный уголь (n=8).
Таблица 57. Значения показателей электрической активности сердца при отравлении дигитоксином в группе мышей, получавших «Литовит-М» (n=8).
Таблица 58. Частота наблюдения нарушений сердечной деятельности при отравлении дигитоксином в контрольной группе животных и в группах животных, получавших активированный уголь и «Литовит-М».
Таблица 59. Показатели смертности животных (%) к 5 часам и 1 суткам при отравлении дигитоксином в контрольной группе животных и в группах животных, получавших активированный уголь и «Литовит-М».
Изучение защитного действия «Литовит-М» при отравлении фосфорорганическими соединениями показало, что «Литовит-М» замедляет развитие неврологических нарушений при отравлении фосфорорганическими соединениями. Эксперименты проведены на 24 беспородных крысах – самцах массой 250 – 300 г. Хлорофос вводили в дозе 300 мг/кг. Через 10 минут после отравления крысам внутрижелудочно вводили активированный уголь или «Литовит-М» (в дозах 250 мг/кг) в 1% крахмальной слизи. Животные контрольной группы получали эквиобъемное количество крахмальной слизи. До и через 1 час после отравления под легким эфирным оглушением регистрировали ЭКГ во II стандартном отведении на электроэнцефалографе EEG – 8S. Оценивали частоту сердечных сокращений (ЧСС), длительность интервалов PQ, QRS и QT, амплитуду зубцов Р, R и Т. В контрольной группе животных после введения хлорофоса в первую очередь развивались гиперкинезы в области жевательных мышц (через 11,6 ± 0,5 мин), которые в дальнейшем переходили в фибрилляции практически всех мышц тела с периодически возникающим общим гипертонусом и тоническими судорогами (через 18,0 ± 1,0 мин) (см. таблицу 60). По данный ЭКГ через 1 час после отравления изменений ЧСС и ритма сердца не наблюдалось, однако, выявлено снижение амплитуды зубцов Р, R и Т на 59%, 72% и 70% соответственно (см. таблицу 61). Введение активированного угля достоверно замедляло время наступления гиперкинезов (в 1,4 раза) и судорог (в 1,7 раза) (см. таблицу 60) и не изменяло параметры ЭКГ по сравнению с контрольной группой. Введение «Литовит-М» также замедляло развитие неврологических нарушений по сравнению с контрольной группой, однако генерализованные фибрилляции и тонические судороги начинали развиваться раньше, чем в группе животных, получавших активированный уголь (см. таблицу 60). Существенных изменений ЭКГ при внутрижелудочном введении «Литовита-М» не наблюдалось, как по сравнению с контрольной группой, так и по сравнению с группой животных, получавших активированный уголь (см. таблицу 61). Изучение защитного действия «Литовит-М» при отравлении фосфорорганическими соединениями. Таблица 60. Влияние «Литовита-М» (250 мг/кг) и активированного угля (250 мг/кг) на развитие неврологических нарушений при отравлении хлорофосом.
Таблица 61. Влияние «Литовита-М» (250 мг/кг) и активированного угля (250 мг/кг) на показатели электрической активности сердца при отравлении хлорофосом у крыс.
ВЫВОДЫ: На основании результатов проведенных исследований можно сделать вывод о том, что БАД к пище «Литовит-М» эффективен в отношении алкалоидов (атропин), барбитуратов (этаминал – натрий), трициклических антидепрессантов (амитриптилин), при отравлении мышьяком, токсичными металлами (медь, барий, свинец) – исследования продукта в опытах in vivo. Для подтверждения полученных результатов «Литовит-М» исследовался в опытах in vitro на крысах. В результате проведенных исследований БАД к пище «Литовит-М» показал свою эффективность как энтеросорбент в отношении: атропина, амитриптилина, дигитоксина, а также фосфорорганических соединений. Данные проведенных экспериментальных исследований позволяют сделать вывод о том, что БАД к пище «Литовит-М» эффективно снижает степень эндогенной интоксикации в отношении вышеперечисленных ядов, что говорит о его сорбционных свойствах. Среди многих систем, обеспечивающих постоянство внутренней среды организма и реализацию защитно – приспособительных реакций, существенная роль принадлежит надпочечникам. На первом этапе исследования БАД «Литовит», было показано, что данный препарат обладает свойствами адаптогена в условиях острого и хронического токсического воздействияна организм животных. В связи с этим представляется актуальным исследование особенностей структурного реагирования надпочечников в условиях фармакологической коррекции патологических состояний с помощью новых препаратов, в состав которых входят биологически активные вещества минерального и растительного происхождения.
НИИ Клинической и экспериментальной лимфологии СО РАМН было изучено влияние БАД к пище «Литовит-Б», содержащей в своем составе цеолит природный, корневище и корень кровохлебки, отруби пшеничные, отруби ржаные на структурную организацию коры надпочечников в условиях эндо- экзотоксикоза. Материалы отчета о НИР «Расширенные экспериментально – клинические исследования влияния на органы и системы организма БАД «Литовит» в сочетании с фитокомпонентами», НИИКиЭЛ СО РАМН, Бородин Ю. И., Горчаков В. Н., Новосибирск, 2000 г. Надпочечники играют огромную роль в защитно-приспособительных реакциях организма, влияют на менструальную функцию, контролируют ряд обменных процессов. Выработка гормонов в надпочечниках зависит от целого ряда биологически активных соединений, имеющихся в надпочечниках, в частности, простагландинов, микроэлементов (кальция, калия) и от возраста. Исследование структурных изменений надпочечников в условиях сочетанного эндо- экзотоксикоза на фоне профилактического приема и коррекции фитоминеральным комплексом «Литовит» - кровохлебка лекарственная («Литовит-Б») показали, что использование фитоминерального комплекса «Литовит-Б» существенно изменяло ответную реакцию надпочечников на эндо- экзотоксикоз. Биологическое действие адаптогенов на интактных животных показало, что в организме развиваются процессы, которые подготавливают его к тому или иному воздействию и обеспечивают более быстрое последующее восстановление гомеостаза. Фитоминеральный комплекс с кровохлебкой («Литовит-Б») достоверное снижал объем клубочковой зоны коры надпочечников в условиях эндо- экзотоксикоза. Использование фитоминерального комплекса с кровохлебкой («Литовит-Б») способствует сохранению размеров сетчатой зоны коры надпочечников в условиях эндо- экзотоксикоза в пределах контрольных значений. Известно, что сетчатая зона коры надпочечников является источником дигидроэпиандростерона и его сульфатной фракции – гормонов, обладающих анаболитическим действием и регулирующих процессы старения, функции иммунной системы, оказывающих адаптогенное влияние (Обут Т.А., 1994., Гончарова Н.Д., 1997 и др.). Следовательно, можно сделать заключение о том, что фитоминеральный комплекс с кровохлебкой («Литовит-Б») оптимизирует структурную организацию коры надпочечников в условиях эндо- экзотоксикоза. Проведенные исследования показали, что:
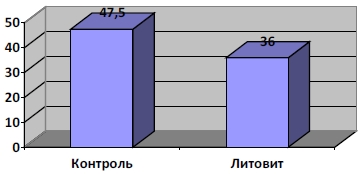
Материалы отчета «Гигиеническая оценка БАД к пище «Литовит», ГУ НИИ Питания РАМН, Лаборатория по изучению новых источников пищевых веществ, Тутельян В. А., Аксюк И. Н., (дополнительное исследование к договору №424 от 17.01.97 года, протокол №30 от 30.01.98 года), Москва, 12.10.1998 -1999 гг. Задачей настоящих исследований явилась оценка БАД к пище «Литовит» в эксперименте на лабораторных животных (крысах линии ВИСТАР) на модели токсического гепатита. Использована модель токсического гепатита с введением внутримышечно тетрахлорметана СCl 4 (50% раствор в подсолнечном масле) в дозе 0,3 мл на 100г массы тела крысы ежедневно на протяжении 7 дней. Для оценки эффективности БАД к пище «Литовит» использованы следующие показатели: интегральные – масса тела, абсолютная и относительная масса печени, почек, селезенки; биохимические – активность аланинаминотрансферазы, аспартатаминотрансферазы и щелочной фосфатазы в сыворотке крови и гомогенате печени, содержание общего билирубина, общего белка, глюкозы и холестерина в сыворотке крови, содержание белка, общих липидов и гликогена в печени, содержание креатина в моче; морфологические – макроскопическое исследование всех внутренних органов и микроскопическое исследование печени и почек. БАД к пище «Литовит» включали в рацион крыс опытной группы в дозе 70 мг/кг массы крысы в течение трех недель до начала введения тетрахлорметана, во время введения тетрахлорметана (7 дней) и 2 недели после отмены введения. Использованы 2 контрольные группы крыс: контроль 1 – крысы находились на общевиварном рационе на протяжении всего эксперимента, контроль 2 – крысам на фоне общевиварного рациона вводили тетрахлорметан. Условия введения те же, что и в опытной группе. Проведено 2 забоя животных: через 4 и 6 недель от начала эксперимента. Введение тетрахлорметана крысам, которые не получали с кормом БАД к пище «Литовит» (контроль 2) привело к статистически достоверным изменениям следующих показателей: уменьшению массы тела крыс, увеличению абсолютной и относительной массы печени, резкому увеличению активности аланинаминотрансферазы и аспартатаминотрансферазы в сыворотке крови, увеличению содержания общего билирубина в сыворотке крови, увеличению содержания общих липидов в печени и снижению содержания гликогена в печени по сравнению с группой контроль 1. При введении тетрахлорметана крысам, которые получали БАД «Литовит», изменение всех изученных показателей было менее выраженным, чем в группе контроль 2 по сравнению с группой 1. Гистологические исследования печени показали, что введение тетрахлорметана крысам без включения в их рацион препарата «Литовит» вызывает резкие повреждения печени, которые захватывают большую часть дольки печени. Эти изменения представляют собой жировую дистрофию гепатоцитов с явлениями некроза и некробиоза. Включение в рацион крыс препарата «Литовит» привело к меньшему распространению патологического процесса в дольке печени. Жировая дистрофия у этих крыс занимала 1/3 и реже 1/2 часть дольки печени. Результаты исследований, проведенных через 2 недели после отмены введения тетрахлорметана, показали, что происходит нормализация некоторых интегральных и биохимических показателей у крыс опытных групп по сравнению с контролем 2 (абсолютная и относительная масса печени, активность аланинаминотрансферазы и аспартатаминотрансферазы в сыворотке крови, содержание общих липидов в печени). Морфологические исследования на этом сроке эксперимента показали, что произошло частичное восстановление структуры печени в зонах бывшего повреждения дольки: разницы в морфологическом состоянии печени между группой опыт и контроль 2 не отмечено. Однако, такие показатели как масса тела и содержание гликогена в печени к этому сроку эксперимента нормализовались только в группе крыс, получавших «Литовит». ВЫВОДЫ: предварительное (на протяжении трех недель) включение в рацион крыс БАД к пище «Литовит» в дозе 70 мг/кг массы крысы оказало защитное действие на организм животных при развитии токсического гепатита, вызванного внутримышечным введением тетрахлорметана. Это подтверждается следующими показателями: активность аланинаминотрансферазы, аспартатаминотрансферазы и щелочной фосфатазы в сыворотке крови, содержание общих липидов в печени, содержание общего билирубина в сыворотке крови, а также масса тела, абсолютная и относительная масса печени, которые при развитии токсического гепатита изменены в значительно меньшей степени у крыс, получавших с рационом «Литовит», чем у крыс, этот препарат не получавших. Гистологические исследования печени также подтвердили защитное действие этого препарата: включение его в рацион крыс привело к меньшему распространению патологического процесса печени (жировая дистрофия с явлениями некроза и некробиоза). Также следует отметить, что содержание гликогена в печени к этому сроку эксперимента нормализовались только в группе крыс, получавших «Литовит». На следующем этапе работы была проведена оценка эффективности БАД к пище «Литовит» на модели экспериментального токсического гепатита у крыс. Использована модель токсического гепатита с введением внутримышечно тетрахлорметана (50% раствор в оливковом масле) в дозе 0,3 мл на 100 г на протяжении 9 дней. Изучена эффективность продукта «Литовит» в дозе 300 мг на 1 кг массы тела. Исследования были проведены на крысах линии Wistar с исходной массой 58-62 г. На первой стадии исследования крысы были разбиты на 2 группы по 40 животных в каждой. Первая группа крыс (контроль 1) находилась на общевиварном рационе. Крысам 2 группы (контроль 2) на фоне общевиварного рациона вводили внутримышечно тетрахлорметан в дозировке, описанной выше, ежедневно на протяжении 9-ти дней. По окончании введения тетрахлорметана часть крыс (по 8 в каждой группе) были забиты и проведены биохимические, гематологические и морфологические исследования для оценки полученной модели токсического гепатита у крыс группы контроль 2. На второй стадии исследования крысы группы контроль 2 были разбиты на 2 подгруппы по 16 крыс в каждой. 1-я подгруппа (контроль 2,1) находилась на общевиварном рационе до конца эксперимента (2 месяца). 2-я подгруппа (опыт) на фоне общевиварного рациона вместе с кормом получала БАД к пище «Литовит» в дозировке, указанной выше, до конца эксперимента (2 месяца). Забои животных и биохимические, гематологические и морфологические исследования крыс проводили через 1 и 2 месяца после получения модели гепатита. Полученная экспериментальная модель токсического гепатита характеризуется увеличением относительной массы печени и почек, увеличением активность аланинаминотрансферазы и содержания прямого билирубина в сыворотке крови, увеличением концентрации креатина в моче, снижением концентрации гемоглобина в крови, значительными морфологическими изменениями в печени (мононуклеарная инфильтрация в центре долек и дистрофические изменения гепатоцитов). Результаты исследования: через месяц у крыс без включения в их рацион «Литовита» еще сохраняется статистически достоверное увеличение содержания общего билирубина в сыворотке крови и дистрофические изменения гепатоцитов.Применение «Литовита» привело к менее выраженному увеличению содержания прямого билирубина в сыворотке крови и менее выраженным дистрофическим изменениям печеночных клеток. Через 2 месяца в группе крыс без включения в их рацион «Литовита» остается статистически достоверное увеличение содержания общего и прямого билирубина, полностью отсутствующее у крыс с включением в их рацион «Литовита». Что касается морфологических показателей, то можно считать, что через 2 месяца после развития токсического гепатита наступило почти полное восстановление печеночной ткани, причем в опытной группе с применением «Литовита» оно отмечено у большего числа крыс. Т.о., включение в рацион крыс продукта «Литовит» в период восстановления после экспериментального токсического гепатита, полученного внутримышечным введением тетрахлорметана в количестве 0,3 мл на 100 г массы тела, применение «Литовита» в дозе 300 мг на кг массы крысы способствовало лучшему восстановлению печеночной ткани, что нашло свое выражение в морфологических и некоторых биохимических (содержание общего и прямого билирубина) показателях. Эффективность использования БАД к пище «Литовит» при отравлении гепатотропным ядом тетрахлорметаном, Институт клинической и экспериментальной лимфологии СО РАМН, Новосибирский государственный медицинский университет, Из кн.: «Использование биологически активных добавок на основе природных минералов для детоксикации организма», с. 112-119, Бгатова Н. П., Новоселов Я. Б., Новосибирск, 2000 год. Цель исследования: изучение гепатопротекторных свойств БАД «Литовит» при отравлении тетрахлорметаном. Тетрахлорметан широко применяется в экспериментальных работах для создания модели повреждения гепатоцитов преимущественно центролобулярных зон печеночных долек (Slater T. F., 1978). Введение даже очень низких доз этого яда (1 мкл на 100 г веса) вызывает повреждение клеток (Reunolds E. S., 1963). Около 80% от введенного тетрахлорметана выделяется в неизменном виде с кислородом воздуха (Collistern R. Et al., 1972). Поэтому возникло предположение, что токсичными являются продукты его метаболизма. Влияние использования БАД «Литовит» на развитие процессов повреждения и восстановления после введения тетрахлорметана. В эксперименте использованы животные, которым вводили раствор CCl 4 через зонд per os. Животные получали стандартный общевиварный рацион + «Литовит» в дозировке 0,1 г/кг веса, контролем служили животные, содержавшиеся на общевиварном рационе. При содержании животных в течение трех недель на рационе с «Литовитом» не было выявлено нарушения структурной целостности эпителиальной выстилки тонкой кишки. Не наблюдали достоверных изменений в структурной организации слизистой оболочки тонкой кишки. Отмечали лишь тенденцию к снижению количества бокаловидных клеток, интраэпителиальных лимфоцитов, макрофагов, эозинофилов и тенденцию к возрастанию количества тучных клеток в кишечных ворсинках животных, получавших «Литовит». В криптах тонкой кишки не происходило изменений клеточного состава органа. Через 24 часа после введения тетрахлорметана отмечали снижение количества бокаловидных клеток и интраэпителиальных лимфоцитов, наиболее выраженное в кишечных ворсинках животных, получавших стандартный рацион. У животных, получавших «Литовит», значительно увеличивалось количество плазматических клеток (в 3 раза), имела место тенденция к возрастанию количества макрофагов, эозинофилов и лимфоцитов, в то время как у животных, содержавшихся на стандартном рационе, данные показатели практически не менялись. В криптах тонкой кишки клеточные параметры значительно не изменялись через 24 часа после отравления животных обеих групп. При исследовании кишечных ворсинок через 7 суток после введения тетрахлорметана, у животных, получавших «Литовит», в собственной пластинке слизистой отмечали повышенное содержание макрофагов и лимфоцитов, а у животных, получавших стандартный рацион – возрастание количества плазматических клеток. В обеих группах восстанавливалась структурная целостность эпителиальной выстилки. Митотическая активность эпителиоцитов в криптах была одинаковая. Ранее было установлено, что использование цеолита в качестве пищевой добавки (6% от веса сухого корма) не оказывает повреждающего действия на эпителиальную выстилку тонкой кишки (Бгатова Н. П., 1997) и способствует увеличению адаптивных функций клеток. Сходные данные были получены и при настоящих исследованиях: при добавлении к рациону «Литовита» исследования слизистой оболочки тонкой кишки свидетельствуют о повышении реактивности клеток при длительном использовании БАД «Литовит» в норме, и после введения тетрахлорметана. Центральным органом метаболизма и регуляции «потока» питательных веществ в организме является печень. Через 3 недели содержания животных на стандартном рационе и рационе с «Литовитом» (0,1 кг/г веса) отмечали увеличение объемов ядер на 34 и 114% соответственно. Объем цитоплазмы гепатоцитов животных, содержавшихся на стандартном с добавлением «Литовита» был на 82% выше, чем у животных, получавших стандартную диету. В обеих группах снижалось количество гепатоцитов и их ядер в тестовой площади. Объемные плотности и количество синусоидальных клеток значительно не изменялись. Количество внутриклеточных органоидов в единице объема цитоплазмы было одинаковым в гепатоцитах у животных обеих групп. В тоже время у животных, получавших «Литовит» на 60% возрастала объемная плотность гликогена. Через 24 часа после введения тетрахлорметана в гепатоцитах отмечали накопление вторичных лизосом и липидных включений, некротические изменения части клеток печени. Объем некроза составлял: у животных, получавших стандартный рацион – 47,5%; у животных, получавших «Литовит» - 36,0%. В обеих группах уменьшалось количество синусоидальных клеток. У животных, получавших «Литовит», снижались объемы ядер и цитоплазмы неповрежденных гепатоцитов на 20 и 25% соответственно. У животных на стандартном рационе данные показатели практически не изменялись. Через 7 суток после введения токсина отмечали полное восстановление органа. Некрозов в печени не наблюдали ни в одной группе животных. Объемы ядер и цитоплазмы гепатоцитов не отличались у животных, получавших и не получавших «Литовит» и в последнем случае были меньше, чем до введения тетрахлорметана на 21% и 33% соответственно. Количество синусоидальных клеток восстанавливалось до исходного значения. Количество внутриклеточных органоидов не отличалось у животных, получавших «Литовит» и содержавшихся на стандартном рационе. По данным Асташовой Т. А. и др. (1997) в условиях коррекции эндотоксикоза препаратом «Литовит», содержание продуктов перекисного окисления липидов (ПОЛ) в печени приближается к показателям у интактных животных. Авторы объясняют этот факт тем, что пероральное введение «Литовита» обладает корригирующим саногенным эффектом при остром эндотоксикозе, активируя барьерно – фильтрационную функцию региональных к месту введения токсина лимфатических узлов, что выражается в восстановлении в них проантиоксидантного равновесия. По – видимому, меньшее повреждающее действие тетрахлорметана на паренхиму печени при использовании «Литовита», связано с активацией антиоксидантной системы печени и меньшей степенью развития процессов ПОЛ в данном случае. ЗАКЛЮЧЕНИЕ: Проведенное исследование показало, что длительное использование с рационом БАД «Литовит» способствовало меньшему повреждающему действию гепатотропного яда тетрахлорметана. Так, через 24 часа после введения яда, в группе «Литовит» отмечали уменьшение некротических изменений клеток печени, что наглядно показывает нижеприведенная диаграмма: Рис. 2. Некротические изменения клеток печени после введения CCl4 через 24 часа
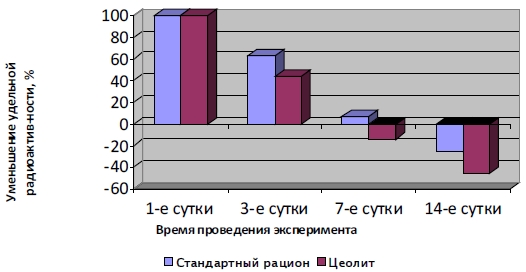
Длительное использование пищевой добавки «Литовит» не оказывает повреждающего действия на эпителиальную выстилку тонкой кишки экспериментальных животных и способствует увеличению адаптивных потенций и реактивности клеток слизистой оболочки ворсинок тонкой кишки. Превентивное11 использование БАД «Литовит» оказывает протекторное действие при поражении печени тетрахлорметаном. Эффективность использования сорбционных препаратов при отравлении фосфорорганическим пестицидом карбофосом, Институт клинической и экспериментальной лимфологии СО РАМН, Из кн.: «Использование биологически активных добавок на основе природных минералов для детоксикации организма», с. 72-111, Бгатова Н. П., Новоселов Я. Б., Новосибирск, 2000 год. Каждый пестицидный препарат, будучи токсичным по отношению к живым организмам, не может не быть потенциально опасным для человека. При поступлении в организм человека даже в очень малых количествах пестициды оказывают влияние на течение биологических процессов, нарушая их обычный ход и вызывая изменение различных физиологических функций, что проявляется в многообразии клинических форм отравлений. Катастрофические последствия антропогенных воздействий пестицидов выражаются в увеличении заболеваемости и смертности населения, в том числе детской, сокращением средней продолжительности жизни, генетическими отклонениями у значительной части населения. Пестициды могут проникать в организм через пищевой канал. Всасывание некоторых из них в кровь начинается уже в верхних его отделах. Основное количество пестицидов проникает в кровоток из тонкой кишки. Многие пестициды сравнительно равномерно накапливаются в тканях организма. Фосфорорганические соединения (ФОС). Данная группа веществ принадлежит к наиболее широко применяемым пестицидам. Для этой группы характерна способность быстро гидролизоваться, с чем связан их слабый кумулятивный эффект. В основе действия ФОС на организм лежит способность угнетать ацетилхолин (локализованный в нервной ткани и эритроцитах) и псевдохолинэстеразу (находящуюся в печени и плазме крови). ФОС особенно широко применяются для борьбы с вредителями растений, экто- и эндопаразитами домашних животных и в быту, причем большая часть их производства и практического использования приходится на карбофос. Остатки карбофоса могут находиться в пробах продуктов питания, особенно животного происхождения, а также в женском молоке. Широкое распространение случаев отравления фосфорорганическим пестицидом карбофосом, проникновение этого токсина в организм через корни лимфатической системы – лимфатические капилляры тонкой кишки, делает актуальным исследование структурных изменений в организме, возникающих под действием данного ксенобиотика и способов их коррекции. Перспективным в этом случае представляется применение природного цеолита Холинского месторождения – минерала, обладающего сорбционными свойствами, основыБАД серии «Литовит». В эксперименте использованы группы животных, которым вводили раствор карбофоса через зонд per os. Животные 1-ой опытной группы со стандартным рационом СУМС -1, животные 2-ой опытной группы со стандартным рационом получали цеолит в дозировке 0,1 г/кг веса, контролем служили животные, содержавшиеся на общевиварном рационе. Результаты исследований: В условиях примерно одинакового стимулирования структурной организации слизистой оболочки тонкой кишки при использовании СУМС-1 и цеолита, имела место более ранняя структурная реакция на токсический стресс микрорайона слизистой оболочки тонкой кишки животных, получавших цеолит. Вероятно, в экспериментальных условиях проявились такие свойства цеолита, как способность отдавать организму микро-, макроэлементы, что способствовало усилению обменных процессов и большей реактивности функциональных систем. Известно, что кровь и лимфа поглощают и выводят значительную часть продуктов метаболизма. Параллельно с кровеносной системой пищеварительного тракта, жирорастворимые пестициды, пройдя эпителий кишечника, попадают в первую очередь в лимфатические капилляры кишечной ворсинки, затем оттекают в брыжеечные узлы, где происходит определенное биологическое инактивирование (Голиков С. Н., Саноцкий И. В., Пиунов Л. А., 1985). Т.о., проникновение фосфорорганического пестицида – карбофоса в организм через корни лимфатической системы – лимфатические капилляры тонкой кишки, делает актуальным исследование структурных изменений лимфатической системы данного региона и способов коррекции патологических изменений, возникающих под действием данного ксенобиотика. Полученные в результате проведенных исследований данные свидетельствуют о протективном действии цеолита на иммунную функцию лимфоидной ткани пейеровой бляшки в условиях острого отравления карбофосом. Наиболее полным восстановление кровеносных и лимфатических капилляров было в слизистой животных, получавших с рационом цеолит. В то время, как эндотелий кровеносных капилляров в большей степени был поврежден у животных, получавший стандартный рацион и рацион с добавлением СУМС-1. На основании проведенных исследований можно сделать вывод, чтоиспользование цеолита природного Холинского месторождения, являющегося основой БАД серии «Литовит», после отравления животных карбофосом способствовало сохранению и усилению иммунной функции лимфоидных образований в стенке тонкой кишки – пейеровых бляшек. Из материалов отчета НИИ Клинической и экспериментальной лимфологии СО РАМН «Эффективность использования сорбционных препаратов для выведения из организма радиоактивного цезия». Институт клинической и экспериментальной лимфологии СО РАМН, Из кн.: «Использование биологически активных добавок на основе природных минералов для детоксикации организма», с. 72-111, Бгатова Н. П., Новоселов Я. Б., Новосибирск, 2000 год. Проблема адаптации живого организма к воздействию окружающей среды вследствие техногенного воздействия и катастроф на сегодняшний день является очень актуальной. Радиационное воздействие один из самых серьезных по своему воздействию факторов. Угрозой радиационного поражения является не только последствия ядерных испытаний и аварий. Постоянной, ежедневной проблемой являются «захороненные» и незахороненные РАО, которые способствуют постоянному накоплению радионуклидов в организмах растительного и животного происхождения, в том числе и человека. Проблема обеззараживания различных сред от радиоактивных веществ, в том числе детоксикация организма человека, стала одной из актуальных в ХХ веке и остаётся не менее актуальной в ХХI веке. Исходя из многочисленных экспериментальных исследований, проведенных, в том числе в Институте Клинической и экспериментальной лимфологии СО РАМН (НИИКиЭЛ СО РАМН), одним из наиболее эффективных способов по уменьшению удельной радиоактивности органов в процессе выведения цезия – 137, является применение стандартной составляющей природного минерала – цеолита Холинского месторождения – БАД к пище «Литовит-М». В настоящее время для выведения из организма инкорпорированных радионуклидов предлагаются к использованию различные энтеросорбенты и пищевые добавки. Эффективность их применения определяется способностью связывать в ЖКТ радионуклиды, микробные и эндогенные токсины, уменьшая масштабы лучевых поражений. В данной работе проведено сравнительное исследование биологических свойств различных типов сорбентов: искусственного углеродминерального сорбента СУМС и природных: «Литовит-М» и диатомита12, а именно: выявление возможности выведения радиоактивных веществ при помощи сорбентов и сохранность тканей печени в данных условиях. Проведено исследование удельной радиоактивности и структурной организации печени при накоплении в организме Cs137 и применение в качестве пищевой добавки «Литовит-М». Материалы и методы исследования Работу проводили совместно с сотрудниками лаборатории экологической эндокринологии Научного центра клинической и экспериментальной медицины СО РАМН, сотрудниками НГМА и сотрудниками Сибирского Федерального Центра оздоровительного питания13. Исследования проводились на 110 самцах крыс породы Wistar, полученных из вивария Новосибирской Государственной Медицинской академии (НГМА), массой 180-220 г. Животные находились на стандартном общелабораторном рационе со световым режимом: 12 часов – день, 12 часов – ночь. Опыты с крысами проводились с 900 до 1300. Раствор радиоактивного цезия вводили животным через зонд per os из расчета 182 кБк/ 100 г массы тела. Контролем (К) служили животные с аналогичным введением дистиллированной воды. При этом у крыс не возникало водной перегрузки, равно, как и выраженных сдвигов в обмене электролитов и гормональных показателей. Для электронной микроскопии образцы печени фиксировали в 1% растворе OsO 4 на фосфатном буфере и заключали в эпон. Полутонкие срезы окрашивали 1% раствором толуидинового голубого. Ультратонкие срезы изучали в электронном микроскопе JEM 1010. Морфометрию проводили согласно рекомендациям Weibel E. R., используя тестовые системы из квадратов. Различия между сравниваемыми средними считали достоверными при р< 0,05 (критерий Стьюдента). Исследования структурной организации печени при накоплении в организме радиоактивного цезия и использования различных сорбентов для его выведения. Исходя из данных, полученных по уменьшению удельной радиоактивности печени следует, что у животных, получавших стандартный рацион, удельная радиоактивность печени на 3-и сутки уменьшалась на 37%, а у получавших «Литовит-М» – на 58%. Через 7 суток на стандартном рационе удельная радиоактивность уменьшилась еще на 56%, а на рационе с «Литовит-М» – на 58%. Через 14 суток удельная радиоактивность печени уменьшилась в обеих группах на 32% (см. таб. 62, рисунок 3). Таблица 62. Изменение удельной радиоактивности печени у животных, получавших стандартный рацион и у животных, получавших стандартный рацион + «Литовит-М».
Через трое и семеро суток после введения цезия паренхима печени выглядела лучше у животных, получавших с рационом «Литовит-М». Имела место тенденция к увеличению объема ядер и цитоплазмы гепатоцитов. Встречались лишь единичные гепатоциты с липидной инфильтрацией. У животных, содержавшихся на стандартном рационе, наблюдали значительные накопления липидов и гликогена в гепатоцитах, снижение объемной плотности митохондрий и поверхностной плотности их внутренних мембран, расширение цистерн гранулярного эндоплазматического ретикулума и аппарата Гольджи. В тоже время удельная радиоактивность печени животных, получавших «Литовит-М» была в 2,2 раза меньше, чем у получавших стандартный рацион. Следовательно, самое сильное снижение радиоактивности печени происходит в первые 3-е суток. Удельная радиоактивность печени стала в 2 раза меньшей на 3-и сутки эксперимента, и эта разница сохранялась на 7-е и 14-е сутки. В итоге удельная радиоактивность печени животных, получавших стандартный рацион,снизилась в 4 раза, а у получавших «Литовит-М» – в 8,5 раз. Рис. 3. Удельная радиоактивность печени на 3,7,14 сутки (в процентном от исходного состояния), на фоне использования стандартного рациона и цеолита.
Выведение цезия с калом у животных, получавших с рационом «Литовит-М» составило 48,41 кБк, диатомит – 40,1 кБк, СУМС – 10,7 кБк и стандартный рацион – 8,39 кБк (см. таб. 63). Таблица 63. Выведение радиоактивного цезия с калом
Как изменялась удельная радиоактивность крови, омывающей печень Через 3-е суток от начала эксперимента удельная радиоактивность крови животных, получавших стандартный рацион снижалась на 12%, а у получавших «Литовит-М» – на 40%. Через 7 суток в первой группе она снизилась на 50%, а в группе, получавшей «Литовит-М» – еще на 60%. Через 14 суток в первой группе удельная радиоактивность снизилась на 40%, а в группе, получавшей «Литовит-М» – на 30% (см. таб. 64). Таблица 64. Изменение удельной радиоактивности крови, омывающей печень у животных, получавших стандартный рацион и у животных, получавших стандартный рацион + цеолит.
В итоге в группе с применением БАД к пище «Литовит-М» удельная радиоактивность крови, омывающей печень, уменьшилась в 1,8 раз больше, чем на стандартном рационе. Эта разница, в основном сформировалась на третьи сутки исследования. Обсуждение результатов исследования: Цитоплазма гепатоцитов (ЦГ), объем цитоплазмы гепатоцитов (ОЦГ), объем ядра гепатоцитов (ОЯГ) – морфофункциональные характеристики активности ана- и катаболических процессов, требующих адекватного обеспечения клетки питательными веществами (биологически активными веществами), необходимыми для работы структур (поддержания жизни клетки). В группе животных, получавших со стандартным рационом «Литовит-М» (группа Ц) показатели ЦГ, ОЦГ и ОЯГ увеличиваются по сравнению с опытной группой животных, получавших СУМС на фоне стандартной диеты (группа С) и с группой животных получавших со стандартным рационом диатомит (группа Д) в период первых семи суток эксперимента. Исходя из характеристик описываемого комплекса показателей, прослеживаемая тенденция является компенсаторным механизмом, направленным на обеспечение (усиление) элиминации ксенобиотиков (каким в данном случае является Cs137), а также переработку токсических соединений, образующихся в результате действия данного элемента. На 14ые сутки объемная плотность структур цитоплазмы гепатоцитов приходит в норму, что свидетельствует о перераспределении временных характеристик компенсаторно – приспособительных реакций в течение первых семи дней в сторону более быстрой реакции адаптивных механизмов на воздействие ионизирующего излучения. Что касается животных, группы С, влияние искусственного углеродминерального сорбента менее выраженно, на рассматриваемые показатели, по сравнению с группами Ц и Д. У животных группы Д стимулирующий эффект наступает на третьи сутки, но он значительно ниже, чем у животных группы Ц. На седьмые сутки стимулирующий эффект диатомита практически равен эффекту СУМС. На 14ые сутки стимулирующий эффект несколько возрастает. Ядра гепатоцитов. Наблюдается снижение объемной плотности структур ядер гепатоцитов. Данный факт свидетельствует о понижении определенных функций жизнедеятельности клеток, обеспечивающих реактивное повышение неспецифической устойчивости, связанное с подавлением клеточных функций таких как, митотическая активность, синтез ДНК и др. (Календо Г. С., 1982). У животных, получавших со стандартным рационом СУМС и диатомит, наблюдается более выраженная динамика данного показателя. Подобная тенденция коррелирует с различиями в динамике показателей ОЦ, ОЦГ, ОЯГ. Соответственно, данный факт свидетельствует об изменении приоритетности защитно – компенсаторных механизмов с прямого увеличения неспецифической резистентности к ионизирующему облучению (гр. С и Д) на пропорциональную мобилизацию активных детоксикационных систем, что обеспечивает снижение необходимой степени угнетения процессов жизнедеятельности клетки (гр. Ц). Данный механизм закономерно обуславливает достоверные различия между животными группы Ц и животными групп К, С, Д в численной плотности двуядерных гепатоцитов, являющихся одним из показателей регенераторно – пластического потенциала структурно – функциональной организации печени. Соответственно, степень сохранения регенераторно – пластического потенциала более близка к контрольным показателям у животных, получавших со стандартным рационом «Литовит-М», по сравнению с группами животных, получавших со стандартным рационом СУМС и диатомит, что в комплексе с повышением показателей активной детоксикации свидетельствует об изменении направленности компенсаторно – приспособительных и защитных механизмов в сторону усиления специфической детоксикации и, следовательно, закономерного уменьшения степени угнетения регенераторно – пластического потенциала. Соответственно, наблюдаются более высокие показатели численной плотности гепатоцитов у животных, получавших со стандартным рационом «Литовит-М» (менее выражены отклонения от нормы), по сравнению с группами К, С, и Д. В целом, воздействие стрессорных факторов (Cs137) сопровождается уменьшением энергетического и пластического резерва (Барабой В. А. с соавторами, 1991), потенцирующее лабилизацию лизосом и пероксисом, нарушения функций митохондрий, ЭПР, биосинтеза макроэргов и др., и, в конечном счете, нарушение функций органов и систем организма. Влияние БАД к пище «Литовит-М» на патогенез радиационного поражения обеспечивает максимальную сохранность клеточных структур, прерывание каскадного механизма патогенетической цепи стрессорных нарушений за счет адаптивного перераспределения активности защитно – компенсаторных систем на стадии изменения энергетического и пластического резерва. ВЫВОДЫ:
В другом эксперименте (проведенном в аналогичных условиях и на аналогичных животных) введение цезия – 137 проводили утром per os в дозе 0,182 кБк на 100 г массы тела животного. Максимальное накопление цезия отмечали в почках (386,0 ± 46,0 кБк), кишечнике (386,0 ± 46,0 кБк), крови (317,2 ± 25,0 кБк). На 14 сутки исследования у животных, получавших стандартный рацион, наибольшая удельная радиоактивность была отмечена в: скелетной мышце (131,0 ± 12,0 кБк), кишечнике (85,0 ± 16,0 кБк) и крови (87,0 ± 13,0 кБк). У животных, содержавшихся на рационе с добавлением «Литовит» более значительно, чем на остальных рационах, снижалась удельная радиоактивность всех органов. В том числе радиоактивность семенников была меньше на 40%, а головного мозга – на 28% по сравнению с животными, содержавшимися на стандартной диете. Т.о., существующие экспериментальные данные убедительно демонстрируют, что добавление к рациону БАД к пище «Литовит» наиболее активно стимулируют выведение из организма радиоактивного цезия. ____________ 8 Атропин – антихолинергическое средство. Препарат, обладающий сильнейшим психотропным действием, вызывает зрительные и слуховые галлюцинации. Передозировка атропина вызывает остановку дыхания и прекращение сердечной деятельности. 9 Этаминал – натрий – относится к вызывающим зависимость снотворным препаратам (барбитураты). В токсичных дозах угнетает внешнее дыхание, деятельность сердечно – сосудистой системы; вызывает развитие нарушения сознания: оглушение, сопор, кома. Тяжелые отравления сопровождаются падением сердечно – сосудистой деятельности, гипорефлексией. Причины смерти: дыхательная недостаточность, острая печеночная недостаточность, шоковая реакция с остановкой сердца. 10 Амитриптилин – является препаратом, представляющим большую угрозу смертельного исхода при сравнительно небольшой дозировке. Прием 1000 – 1500 мл приводит к развитию смертельно опасного отравления. 11 Превентивное – предшествующее, предупреждающее 12 Диатомиты – осадочные горные породы, состоящие преимущественно из раковинок диатомитовых водорослей. Диатомит обладает большой пористостью, способности к адсорбции. Используется как адсорбент в том числе в пищевой промышленности. 13 Работу по изучению эффективности использования природных сорбентов для выведения радиоактивного цезия проводили в специально оборудованном по 2-му классу работ с радиоактивными веществами помещении Межинститутской радиоизотопной лаборатории СО РАМН совместно с сотрудниками лаборатории эндокринологии Научного центра клинической и экспериментальной медицины СО РАМН (рук. д.б.н. Селятицкая В. Г.).
Понравился сайт и статья? Они у нас выходят регулярно. Вступайте в команду Урал Арго: 
Эта статья о болезнях: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

.gif)