


|
Статьи \ Биолит \ Положительное действие гепатосола при экспериментальном синдроме Рейе
04.06.2012
Положительное действие гепатосола при экспериментальном синдроме Рейе
Синдром Рейе развивается на фоне острых респираторно-вирусных заболеваний (60-80% случаев), ветряной оспы (20-30%), диареи вирусной этиологии (5-15%) [7, 8, 9]. Описан синдром Рейе при вирусном гепатите А [16] и СПИДе [10]. Большинство заболевших принимали при вирусной инфекции ацетилсалициловую кислоту, или аспирин. Синдром поражает детей 6-9 и 11-14 лет в период их интенсивного роста и развития, но болезнь не щадит и грудничков. Известны редкие случаи заболевания у взрослых [1, 2, 5, 6]. Население США о коварстве аспирина узнало от своего здравоохранительного ведомства в 1982 г. Первоначально в Штатах считали опасным применение салицилатов (аспирина, или ацетилсалициловой кислоты) при ветрянке и гриппе. Позднее их перестали назначать при любых вирусных и кишечных инфекциях. В 1986 г. предупреждения были опубликованы в Великобритании, где все лекарственные формы аспирина сразу же изъяли из продажи. В Минздраве СССР об этом, конечно, знали, но, "чтобы не пугать людей", истину скрыли. Мы продолжаем использовать его для снижения температуры у детей до сих пор. Добросовестные и хорошо подготовленные педиатры, если им позволяет время, просвещают родителей своих маленьких пациентов, но мамы, не имея полной информации, игнорируют советы врачей и по старинке продолжают давать детям "проверенное", как им кажется, средство. Поначалу синдром Рейе отмечался в США, затем его научились распознавать в Европе, Центральной и Южной Америке, на Ближнем Востоке. Сведений о болезни в странах СНГ нет. Врачи говорят, что лучше всех о ее частоте могут быть осведомлены патологоанатомы. Высокая летальность и недостаточная эффективность современных методов фармакотерапии синдрома Рейе определяют необходимость создания препаратов, способных сдерживать прогрессирование и вызывать обратное развитие поражения печени при синдроме Рейе с восстановлением антитоксической функции этого органа. Мы исследовали влияние гепатозащитного средства гепатосол при данной патологии. Экспериментальные животные и условия опыта В работе использовали модель экспериментального синдрома Рейе, вызванного у крыс внутрибрюшинным введением раствора 4-пентеноевой (аллилуксусной) кислоты [13,14,15]. Данная модель позволяет воспроизводить синдром Рейе, в том числе отдельные стадии патологических процессов, и подтверждать результаты морфологическими и биохимическими исследованиями. Подобную модель используют для оценки эффективности и установления механизма действия лекарственных средств, регулирующих функции печени [15].
Эксперименты проводили в осенне-зимние сезоны на 200 белых беспородных крысах-самцах массой 200-220 г. Животные находились в стандартных условиях вивария, в параллельно исследуемых группах (по 8-10 крыс), имели одинаковую массу тела, контролируемую ежедневным взвешиванием для коррекции вводимой дозы препаратов. Все манипуляции (взвешивание, введение препаратов, забой) осуществляли с 900 до 1200 часов. Животные в течение 7 дней ежедневно получали внутрибрюшинные инъекции 0,5% раствора 4-пентеноевой кислоты (ICN , США) в дозе 20 мг/кг. С 8-го дня после начала интоксикации крысам вводили в желудок гепатосол (5 мл/кг, что соответствует 160 мг/кг экстрактивных веществ). Крысы контрольной группы получали легалон (200 мг/кг). Дозы препаратов являются эффективными терапевтическими. Продолжительность фармакотерапии составляла 30 дней. Результаты исследования
Гепатопротекторы ослабляли биохимические нарушения, вызванные 4-пентеноевой кислотой, и изменяли показатели в сторону нормы: уменьшалась активность ферментов, общего и непрямого билирубина, увеличивался коэффициент глюкуронирования, уменьшалось количество аммиака, липидов, триглицеридов, МДА, свободных фенолов, содержание мочевины, глюкозы, белка и кетоновых тел. В тканях печени и головного мозга уровень аммиака снижался, кетоновых тел - возрастал. Наибольшей фармакологической активностью обладал гепатосол. Он достоверно эффективнее, чем легалон, снижал активность трансаминаз, КФ, ЩФ и у-ГТП, уменьшал содержание общего и непрямого билирубина, липидов, триглицеридов, МДА, аммиака и свободных фенолов, увеличивал синтез мочевины, глюкозы и кетоновых тел (диагр). В ткани печени и головного мозга снижал концентрацию аммиака и повышал уровень ацетона и бета-оксибутирата. Растительные гепатопротекторы, оказывая антиоксидантное действие, улучшали функцию печени при экспериментальном синдроме Рейе, вызванном интоксикацией 4-пентеноевой кислотой. Гепатосол и в меньшей степени легалон уменьшали гиперлипидемию, вероятно, в результате стимуляции Р-окисления длинноцепочечных и среднецепочечных жирных кислот в митохондриях; подавляли продукцию МДА; стабилизировали плазматическую мембрану гепатоцитов с торможением диффузии ферментов; активировали синтез белка и экскрецию билирубина. Ликвидацию гипогликемии можно объяснить восстановлением гликонеогенеза из кетоновых тел - продуктов бета-окисления жирных кислот. Гепатопротекторные средства стимулировали антитоксическую функцию печени: повышали глюкуронирование билирубина, нейтрализацию фенолов и утилизацию аммиака в составе мочевины. Таким образом, гепатосол обладает выраженным терапевтическим эффектом при синдроме Рейе: он улучшает функциональные пробы печени и состояние головного мозга. По производимому эффекту гепатосол превосходит контрольный препарат легалон. Полученные данные позволяют рекомендовать гепатосол в комплексной терапии синдрома Рейе. А лучше всего не дожидаться этого зловещего заболевания, а поддерживать слабый детский организм при острых вирусных или респираторных заболеваниях этим замечательным средством - гепатосолом! Согласно мировой статистике, частота синдрома Рейе составляет от 0,2 до 4 % на 100 000 инфекционных больных. В общем, это немного. Но если гибнет ваш малыш, какое вам дело до процентов? Каждый ребенок - единственный и неповторимый. Берегите свое сокровище! Литература 1. Reye R., Morgan С , Baral J. Encephalopathy and fatty degeneration of the viscera: A disease entity in childhood // Lancet. 1963. Vol. 2. P. 749-752. 2. Somatic evoked potential evaluation of cerebral status in Reye syndrome / W. Goff, B. Shaywitz, GD. Goff. et al. // Electroenceph. clin. Neurophysiol. 1983. Vol. 55, № 4. P. 388-398. 3. National surveillance for Reye syndrome: a five-year review / E. Hurwitz, D. Nelson, C. Davis, et al. // Pediatrics 1982. Vol. 70, № 6. P. 895-900. 4. Reyes syndrome and salicylate use / K. Starko, C. Ray, L. Dominguez. et al. // Pediatrics. 1980. Vol. 66, № 6. P. 859-864. 5. Bonnell H., Beckwith J. Fatty liver in sudden childhood death. Implications for Reye’s syndrome? // Am. J. Dis. Child. 1986. Vol. 140, № 1. P. 30-33. 6. Reye’s syndrome in Spain, 1980-1984 / A. Palomeque, P. Domenech, A. Martinez, et al. // An. Esp. Pediatr. 1986. Vol. 24, № 5. P. 285-289. 7. Fatal adenovirus infection associated with new genome type / A. Mistchenko, J. Robaldo, F. Rosman. et al. // J. Med. Virol. 1998. Vol. 54, № 3. P. 233-237. 8. Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus / E. Claas, A. Osterhaus, R van Beek. et al. // Lancet. 1998. Vol. 351, № 9101. P. 472-477. 9. Larsen S. Reyes syndrome // Med. Sci. Law. 1997. Vol. 37, № 3. P. 235-237. 10. Jolliet P., Widmann J. Reyes syndrome in adult with AIDS // Lancet. 1990. Vol. 335, № 8703. P. 1457. 11. Hayase Y., Tobita K. Influenza virus and neurological diseases // Psychiatry Clin. Neurosci. 1997. Vol. 51, №4. P. 181-184. 12. Robinson D., Abdel-Rahman S., Nahata M. Guidelines for the treatment of Helicobacter pylori in the pediatric population // Ann. Pharmacother. 1997. Vol. 31, №10. P. 1247-1249. 13. Glasgow A., Chase H. Production of the features of Reye’s syndrome in rats with 4-pentenoic acid // Pediatr. Res. 1975. Vol. 9, № 3. P. 133-138. 14. Microvesicular fatty liver in rats with resembling Reye’s syndrome induced by 4-pentenoic acid / N. Sakaida, H. Senzaki, N. Shikata, S. Morii // Acta. Pathol. Jpn. 1990. Vol. 40, № 9. P. 635-642. 15. The effect of L-carnitine supplementation in 4-pentenoic acid treated rats / T. Sugimoto, M.Woo, N. Nishida. et al. // Brain. Dev. 1990. Vol. 12, № 4. P. 417-422.
Понравился сайт и статья? Они у нас выходят регулярно. Вступайте в команду Урал Арго: 
|
 Синдром Рейе - острое заболевание, проявляющееся токсической энцефалопатией (поражение головного мозга), жировым поражением внутренних органов, и в первую очередь - печени. Впервые был описан в 1963 г. врачом из Сиднея (Австралия) Ralph Douglas Kennet Reye с сотрудниками G . Morgan и J . Boral у 21 ребенка; 17 из этих детей погибли [1]. С тех пор в зарубежной литературе ежегодно публикуется большое количество работ, посвященных синдрому Рейе.
Синдром Рейе - острое заболевание, проявляющееся токсической энцефалопатией (поражение головного мозга), жировым поражением внутренних органов, и в первую очередь - печени. Впервые был описан в 1963 г. врачом из Сиднея (Австралия) Ralph Douglas Kennet Reye с сотрудниками G . Morgan и J . Boral у 21 ребенка; 17 из этих детей погибли [1]. С тех пор в зарубежной литературе ежегодно публикуется большое количество работ, посвященных синдрому Рейе. 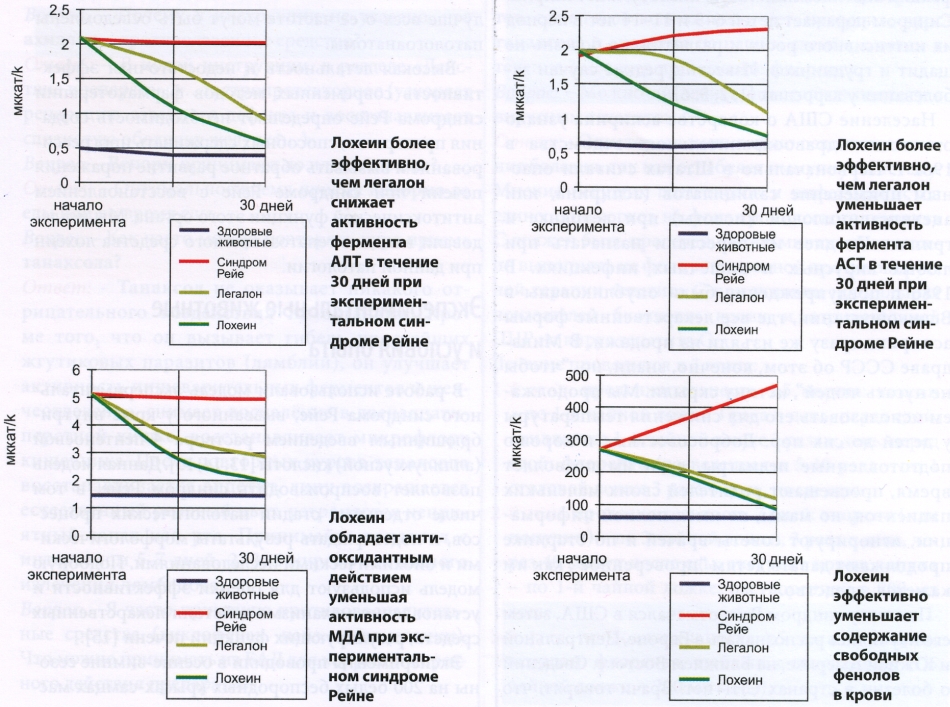
 У крыс, не получавших лечение в течение 30 дней после интоксикации 4-пентеноевой кислотой, прогрессировали биохимические нарушения. Отличия от показателей нормы становились более значительными, чем после 7 дней введения токсина. В крови повышалась активность ферментов ACT, АЛТ (в 3,6-8,8 раза), увеличивалось количество билирубина (общего - в 2,2, непрямого - в 9,7 раза). Глюкуронирование билирубина снижалось до 57 %. Содержание в сыворотке крови аммиака, общих липидов, триглицеридов, МДА и свободных фенолов возрастало в 3,2-7,8 раза, мочевины, глюкозы, белка и кетоновых тел - снижалось в 2,1-5 раз. В тканях печени и головного мозга концентрация аммиака увеличивалась в 6,1-6,9 раза, кетоновых тел - уменьшалась в 2,8-5,1 раза.
У крыс, не получавших лечение в течение 30 дней после интоксикации 4-пентеноевой кислотой, прогрессировали биохимические нарушения. Отличия от показателей нормы становились более значительными, чем после 7 дней введения токсина. В крови повышалась активность ферментов ACT, АЛТ (в 3,6-8,8 раза), увеличивалось количество билирубина (общего - в 2,2, непрямого - в 9,7 раза). Глюкуронирование билирубина снижалось до 57 %. Содержание в сыворотке крови аммиака, общих липидов, триглицеридов, МДА и свободных фенолов возрастало в 3,2-7,8 раза, мочевины, глюкозы, белка и кетоновых тел - снижалось в 2,1-5 раз. В тканях печени и головного мозга концентрация аммиака увеличивалась в 6,1-6,9 раза, кетоновых тел - уменьшалась в 2,8-5,1 раза.