

|
Статьи \ Клинические исследования \ Влияние тонизида на работу сердечно-сосудистой системы
06.07.2012
Влияние тонизида на работу сердечно-сосудистой системы
Как помочь сердцу преодолеть «удары судьбы»? Как научить его существовать в суровых условиях нашего экстремального и жестокого бытия? Об этом всегда задумывались и непрерывно продолжают мыслить ученые-медики. Цель настоящего исследования: оценить антигипоксические, кардиопротекторные и антиаритмические свойства комплексного адаптогенного препарата растительного происхождения тонизид. Работа выполнена в лаборатории экспериментальной кардиологии НИИ кардиологии Томского научного центра СО РАМН, под руководством профессора, д.м.н. Л.Н. Маслова. МЕТОДИКА ИССЛЕДОВАНИЯ Эксперименты по оценке антигипоксического эффекта адаптогена (тонизид) проводились на белых мышах-самцах массой 18-22 г. Для изучения антигипоксического эффекта использовалась модель гипобарической гипоксической гипоксии [7]. Для создания необходимого разряжения воздуха использовали барокамеру «Ока - МТ» (Россия). Антигипоксический эффект тонизида оценивали по проценту, мышей, погибших в течение 20 мин при давлении, которое соответствовало высоте 10500 м над уровнем моря [7]. Эксперименты по моделированию коронароокклюзии были выполнены на крысах линии Вистар массой 200-250 г. Коронароокклюзию и реперфузию моделировали на животных, наркотизированных альфа-хлоралозой (50 мг/кг, внутрибрюшинно) [11], в условиях искусственной вентиляции легких воздухом. Продолжительность коронароокклюзии составляла 45 мин, затем развязывали лигатуру и начинали реперфузию, которая длилась 2 ч. После чего повторно завязывали лигатуру. Для определения зоны риска (зона ишемии) крысам внутривенно вводили краситель patent blue violet, как рекомендовано в литературе [11]. Сердце извлекали из грудной клетки, делали поперечные срезы толщиной 2-3 мм, иссекали неокрашенные участки сердца (зона ишемии) и помещали их в раствор нитротетразолия (nitrotetrazolium blue chloride) [11]. Ишемизированная, но здоровая ткань сердца окрашивалась в синий цвет, а некротизировавшийся миокард сохранял бледную окраску. Размер зоны некроза и зоны риска определяли гравиметрически [11]. Кардиопротекторный эффект препаратов оценивали по соотношению зона некроза/зона риска (ЗН/ЗР), которое выражали в процентах [11]. ЭКГ регистрировали непрерывно в течение 45 мин ишемии и 10 мин последующей реперфузии. Запись ЭКГ осуществляли в первом грудном отведении с помощью усилителя биопотенциалов (УБФ4- 03, Россия) и компьютера IBM 486 с использованием оригинальной прикладной программы. При анализе ЭКГ принимали во внимание частоту возникновения единичных и множественных желудочковых экстрасистол, желудочковой тахикардии, фибрилляции желудочков. Исследовали комплексный адаптогенный препарат тонизид, содержащий экстракты элеутерококка, родиолы розовой, женьшеня и аралии [8]. Тонизид был разработан и произведен на предприятии ООО «Биолит», г. Томск. После растворения в воде препарат вводили внутрижелудочно с помощью зонда. Дозировка экстрактов элеутерококка, родиолы, женьшеня и аралии составляла 4 мг/кг для каждого адаптогена. Для оценки антигипоксической активности тонизида использовали следующую схему введения адаптогена: (а) один раз в день в течение 5 дней, последнее введение за 2 ч до гипоксии; (б) один раз в день в течение 5 дней, последнее введение за 24 ч до гипоксии; (в) один раз за 24 ч до гипоксии. В качестве препарата сравнения использовали ноотропил (пирацетам) производства USB S.A. Pharma Sector (Шеман дю Форе, Бельгия), который обладает антигипоксической активностью [7]. Этот препарат растворяли в воде и вводили через зонд в дозе 400 мг/кг один раз в день в течение 5 дней, последнее введение - за 2 ч до гипоксии. При выборе дозы пирацетама мы руководствовались литературными данными о его антигипоксической активности [7]. В качестве контроля использовали животных, которым через зонд вводили воду.
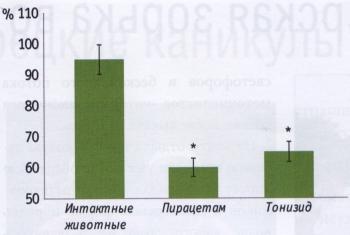
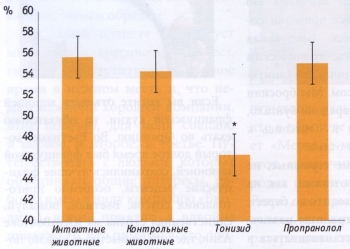
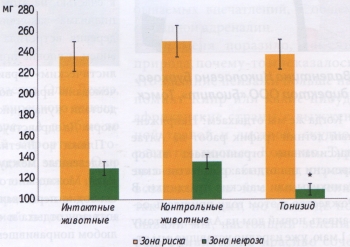
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Как показано на рис. 1, 20-минутая гипоксия (10500 м над уровнем моря) заканчивалась гибелью 95% мышей в группе контроля. В группе животных, получавших тонизид, летальность составила 65%, если препарат вводили в течение 5 суток, а последнее введение производилась за 2 ч до гипоксии. Если же последнее введение проводилось за 24 ч до помещения животных в барокамеру, то летальность составила 60%. Пирацетам оказывал антигипокси- ческий эффект, сопоставимый с эффектом тонизида. При однократном введении тонизида нам не удалось добиться достоверного увеличения устойчивости животных к гипоксии. Таким образом, только курсовое введение обеспечивало повышение толерантности животных к гипоксии. Этот факт согласуется с литературными данными о том, что защитный эффект адаптогенов достигает максимума при курсовом введении [1, 5, 8]. Связано это, очевидно с тем, что протекторное действие адаптогенных препаратов зависит от синтеза белков de novo [1]. Принято считать, что повышение устойчивости к гипоксии является типичным проявлением адаптогенной активности препарата [1]. Если принять во внимание тот факт, что в состав тонизида входили известные адаптогены (элеутерококк, родиола, женьшень и аралия), то результаты наших исследований можно рассматривать, как доказательство адаптогенной активности тонизида. Мы предположили, что антигипоксическое действие тонизида может реализоваться не только на уровне организма, но и на уровне сердца. В пользу подобного предположения говорили литературные данные о том, что некоторые препараты, полученные из растительного сырья, могут предупреждать появление реперфузионной сократительной дисфункции изолированного перфузируемого сердца [12]. Как показано, на рис. 2а, курсовое введение тонизида в течение 5 дней вызывает достоверное уменьшение отношения ЗН/ЗР Одним из основных проявлений ишемического и реперфузионного повреждения сердца являются желудочковые аритмии. Если препарат предупреждает появление необратимых повреждений кардиомиоцитов при коронароокклюзии и реперфузии, то логично было предположить, что он может предупредить возникновение ишемических и реперфузионных аритмий. Кроме того, результаты наших предварительных исследований свидетельствовали о том, что курсовое введение экстракта родиолы повышает устойчивость крыс к аритмогенному действию адреналина [3, 4]. Экстракт родиолы входит в состав тонизида, поэтому мы предположили, что названный комплексный адаптоген также может обладать антиаритмической активностью. Для того, чтобы оценить антиаритмические свойства тонизида, регистрировали ЭКГ в течение 45- мин ишемии и последующей 10-минутной реперфузии. Следует отметить, что патогенез аритмий, возникающих при ишемии и реперфузии, существенно разнится [10], поэтому анализ нарушений сердечного ритма при коронароокклюзии и реперфузии мы осуществляли раздельно. Кроме того, известно, что механизм возникновения аритмий в первые 10 мин ишемии (фаза 1а) и механизм появления ишемических нарушений ритма сердца после 10-минутной коронароокклюзии (фаза lb) также отличаются друг от друга [10]. Исходя из вышесказанного, мы анализировали частоту и характер аритмий, возникающих в первые 10 мин коронароокклюзии (фаза 1а), в последующие 11-45 мин ишемии (фаза 1b) и в первые 10 мин реперфузии. Как видно, из табл., тонизид не оказывал достоверного эффекта на частоту и характер нарушений сердечного ритма, возникающих при реперфузии и в фазу 1а ишемии. В тоже время у крыс, получавших тонизид, не было зафиксировано ни одного случая фибрилляции желудочков в фазу 1b коронароокклюзии. Почему антифибрилляторный эффект проявляется только в фазу 1b? На наш взгляд, ответ кроется в патогенезе необратимых повреждений кардиомиоцитов и в механизме кардиопротекторного действия тонизида. Известно, что некротическая гибель кардиомиоцитов отмечается только при продолжительности ишемии более 10 - 15 мин [9]. В этой связи следует обратить внимание читателя на тот факт, что тонизид замедляет появление необратимых повреждений в кардиомиоцитах, именно с этим эффектом связано кардиопротекторное действие этого препарата при 45-минутной ишемии-реперфузии. Следовательно, есть основание полагать, что антифибрилляторное действие тонизида является следствием его кардиопротекторной активности. Таким образом, результаты наших исследований свидетельствуют о том, что комплексный растительный препарат тонизид обладает антигипоксической, кардиопротектоной и антифибрилляторной активностью. ЛИТЕРАТУРА 1. Дардымов И.В., Хасина Э.И. Элеутерококк: Тайны "панацеи". СПб.: Наука, 1993. 2. Дженнингс Р.Б., Реймер К.А. II Метаболизм миокарда. Материалы 2-го советско-американского симпозиума 28 - 30 мая 1975 г. Сочи. / Под ред. Е.И. Чазова, Х.Е. Моргана. М., Медицина 1977. С. 90-108. 3. Лишманов Ю.Б., Крылатое А.В., Маспов Л.Н. и др. II Бюл. экспер. биол. и мед. 1996. № 3. С. 256-258. 4. Лишманов Ю.Б., Маслова Л.В., Маслов Л.Н., Даньшина Е.Н. II Бюл. экспер. биол. и мед. 1993. № 8. С. 175-176. 5. Маслова Л.В., Кондратьев Б.Ю., Маслов Л.Н., Лишманов Ю.Б. II Экспер. и клин, фармакол. 1994. Т. 57, №6. С. 61-63. 6. Меерсон Ф.З., Малышев И.Ю. Феномен адаптационной стабилизации структур и защита сердца. М., Наука, 1993. 7. Островская Р.У., Трофимов С.С, Буров Ю.В. и др. II Хим.- фарм. журн. 1993. №8. С. 13-16. 8. Саратиков А.С, Краснов Е.А. Родиола розовая (золотой корень). 4-е изд., перераб. и доп. Томск: Изд-во Том. ун-та, 2004. 9. Jennings R.B., Reimer К . А . II Stunning, Hibernation, and Preconditioning: Clinical Pathophysiology of Myocardial Ischemia. / Eds. G.R. Heyndrickx, S.E Vatner, W. Wijns, Lippincott-Raven Publishers, Philadelphia 1997. P. 83-104. 10. Kloner R.A., Rezkalla S.H. II J. Am. Coll. Cardiol. 2004. Vol. 44. N 2. P. 276-286. 11. Schultz J.E.J., Qian Y.Z., Gross G.J., Kukreja R.C. II J. Mol. Cell. Cardiol. 1997. Vol. 29. P. 1055-1060. 12. Wang N., Minatoguchi S., Arai M. et al. II Am. J. Chin. Med. 2004. Vol. 32, N 4. P. 587-598.
Рис. 1. Антигипоксический эффект пирацетама и тонизида (летальность от гипоксии в %) * - р<0,05 по сравнению с интактными животными Количество животных в каждой группе - 20
Рис. 2а. Влияние тонизида и пропранолола на величину соотношения зоны некроза к зоне риска * - р<0,05 по сравнению с интактными иконтрольными животными Количество животных в каждой групее - 15
Рис. 26. Влияние тонизида на размер зоны некроза и зоны риска * - р<0,05 по сравнению с интактными и контрольными животными Количество животных в каждой группе -15 Таблица ВЛИЯНИЕ ТОНИЗИДА НА ЧАСТОТУ ВОЗНИКНОВЕНИЯ ИШЕМИЧЕСКИХ (45 МИН) И РЕПЕРФУЗИОННЫХ (10 МИН) АРИТМИЙ Ишемия (10 мин) Ишемия (35 мин) Реперфузия (10 мин)
Примечание:
Понравился сайт и статья? Они у нас выходят регулярно. Вступайте в команду Урал Арго: 
|

 Сердце человека удивительный орган, которому посвящены сотни тысяч страниц научных фолиантов и великое множество поэтических томов. Для одних - это просто мышечный насос, предназначенный для перекачивания крови, для других - вместилище души, способное трепетать от счастья, страдать в тисках любви, захлебываться от восторга, гореть в огне ненависти и рваться от напряжения. Расхожая фраза «Пока бьется сердце» давно стала демаркационной линией между жизнью и смертью. Сердце - колоссальный и незаменимый труженик, которому мы часто платим черной неблагодарностью пренебрежения и халатности.
Сердце человека удивительный орган, которому посвящены сотни тысяч страниц научных фолиантов и великое множество поэтических томов. Для одних - это просто мышечный насос, предназначенный для перекачивания крови, для других - вместилище души, способное трепетать от счастья, страдать в тисках любви, захлебываться от восторга, гореть в огне ненависти и рваться от напряжения. Расхожая фраза «Пока бьется сердце» давно стала демаркационной линией между жизнью и смертью. Сердце - колоссальный и незаменимый труженик, которому мы часто платим черной неблагодарностью пренебрежения и халатности.